ctDNA评估肿瘤克隆性可预测局晚期NSCLC免疫治疗获益及预后

导语
PACIFIC研究证实了同步放化疗后加入度伐利尤单抗作为巩固治疗可显著改善不可切除Ⅲ期非小细胞肺癌患者生存,并已成为不可手术切除局晚期非小细胞肺癌(LA-NSCLC)的临床治疗标准。然而临床上仍有2/3的LA-NSCLC患者在接受同步放化疗和巩固免疫治疗后出现进展,因此亟待寻找有效的生物标志物去预测这部分患者的预后及治疗疗效。
中国医学科学院肿瘤医院王绿化教授、毕楠教授团队前瞻性地对接受根治性放/化疗的LA-NSCLC患者进行ctDNA动态监测,创新性地提出由ctDNA定义的肿瘤克隆性可预测患者的预后及巩固免疫治疗疗效。相关研究成果于近日发表在Cancer Letters (IF=9.7 ) 。
研究亮点
1. 本研究创新性地发现mmVAF(平均变异等位基因频率与最大变异等位基因频率的比值)可用于评估肿瘤的克隆性,并提示患者的预后;
基于前瞻性研究设计,揭示了巩固免疫治疗前及动态ctDNA mmVAF有利于识别较高复发风险及巩固免疫治疗潜在获益的患者,有助于优化LA-NSCLC患者的治疗策略。
研究结果
基于组织的mmVAF可反映肿瘤的克隆性,克隆优势肿瘤与较差的OS相关
本研究首先分析了TCGA队列431例不可切除的LA-NSCLC患者的多种基因组特征与预后的关系。研究发现最大变异等位基因频率(max VAF)、平均变异等位基因频率(mean VAF)、最小变异等位基因频率(min VAF),以及突变数量等指标均与OS没有相关性(图1A)。进一步研究发现,mmVAF(mean VAF/max VAF)与亚克隆的数量以及亚克隆与总突变数量的比例(No.s/m)呈显著负相关(图1B,C),这意味着肿瘤组织的mmVAF可潜在反映肿瘤的克隆性,较高的mmVAF提示为克隆优势肿瘤。与mmVAF低的患者相比,mmVAF高的患者OS显著更差(图1D);联合临床特征进行多因素分析后,mmVAF与OS之间仍具有显著相关性(图1E)。
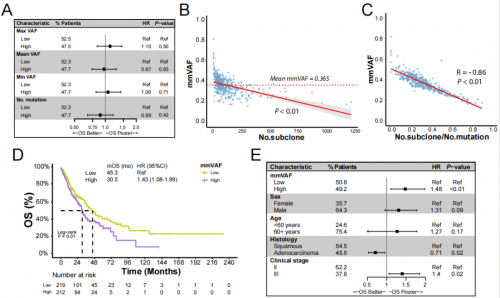
图1. 基于组织的mmVAF与肿瘤克隆性及OS相关性分析
基于血浆ctDNA的mmVAF也可反映肿瘤的克隆性,mmVAF高的OS较差
考虑到不可切除LA-NSCLC组织样本的可及性问题,研究进一步评估了血浆ctDNA的mmVAF的临床适用性,纳入共70例接受了根治性RT/CRT的LA-NSCLC患者,分别在基线(TP0)、放疗第4周(TP1)、巩固免疫治疗前(TP2)、放疗后3个月(TP3)、PD(TP4)时共5个时间点采集血浆样本。其中,基线ctDNA阳性率是71.4%(50/70);基线血浆最常见的突变基因是TP53(50.0%),其次是LRP1B(15.7%)以及肺癌常见驱动基因如KRAS(10.0%)、EGFR(8.6%)、ALK(7.1%)和ROS1(7.1%)。与TCGA队列中的结论相似,基于ctDNA的mmVAF与血浆中亚克隆的数量、No.s/m之间显著相关,这表明基于ctDNA的mmVAF也可反映肿瘤的克隆性。TP0 mmVAF较高的患者OS也较差(图2)。

图2. 基于血浆ctDNA的mmVAF与肿瘤克隆性及OS的相关性
巩固免疫治疗前的克隆优势肿瘤患者可从巩固免疫治疗中获益
研究进一步探索了mmVAF对基线ctDNA阳性的50例患者巩固免疫治疗获益的预测作用。TP0 mmVAF较高的患者接受巩固免疫治疗PFS获益更好;而在未接受巩固免疫治疗的患者中较高的mmVAF提示与较差的PFS相关。这提示基线血浆mmVAF可能可以预测巩固免疫治疗的获益(图3A)。mmVAF和No.s/m之间具有较强的相关性,但研究发现在基线No.s/m较低的患者中,虽然巩固免疫治疗与更好的PFS相关,但并无统计学差异(图3B)。因此对基线未检测到亚克隆的26例患者进一步分层,在TP0 mmVAF高的18名患者中,接受了巩固免疫治疗的患者,PFS要优于未接受巩固免疫治疗的患者(图3C,3D)。这意味着在基线检测不到亚克隆的患者,mmVAF是巩固免疫治疗决策潜在的分子标志物。
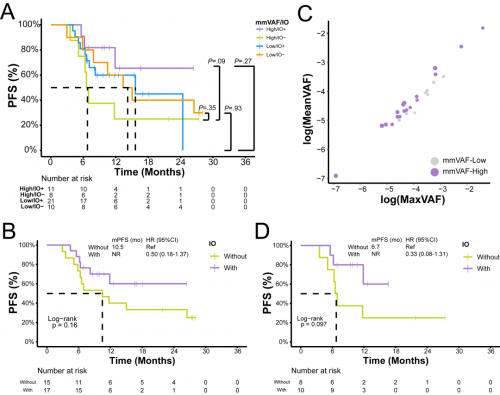
图3. 治疗前的mmVAF与巩固免疫治疗获益之间的相关性
接下来研究进一步探索了经RT/CRT治疗后ctDNA的预后意义。与TP1 ctDNA阴性的患者相比,ctDNA阳性患者显示出显著较差的PFS(图4A)。同样,TP2 ctDNA阳性也与较差的PFS相关,并且多因素分析显示TP2 ctDNA状态是PFS的有力预测因素(图4B,C)。TP2 ctDNA阳性患者接受巩固免疫治疗后PFS显著延长(图4D);依据mmVAF值和巩固免疫治疗进一步分层后发现,在克隆优势肿瘤患者中,接受巩固免疫治疗的患者,PFS显著优于未接受巩固免疫治疗的患者(图4E)。
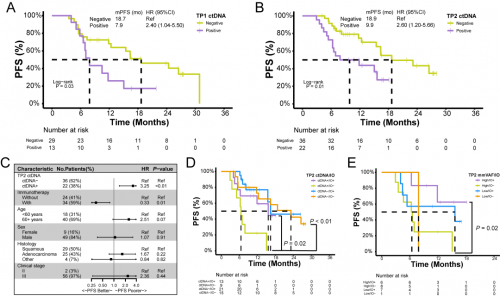
图4. 放疗期间或放疗后的ctDNA及mmVAF对预后的预测作用
ctDNA动态监测中克隆性增加与PFS较差相关,但可受益于巩固免疫治疗
基于TP0和TP1的ctDNA动态变化,患者被分为mmVAF增加、mmVAF未增加,以及ctDNA保持阴性三个亚组;与mmVAF增加的亚组相比,mmVAF未增加及ctDNA阴性患者均显示更好的PFS(图5A);对TP0和TP2的动态变化分析也获得了相似的结果(图5B)。接下来,研究进一步探讨了mmVAF的动态变化与巩固免疫治疗获益的相关性。mmVAF增加亚组中8名未接受巩固免疫治疗的患者100%出现了疾病进展,而接受巩固免疫治疗的患者仅54.5%发生疾病进展(p=0.05)。生存分析显示,mmVAF增加亚组患者接受巩固免疫治疗PFS获益明显,而ctDNA保持阴性/mmVAF未增加的患者从巩固免疫治疗获益有限(图5C)。特别是在mmVAF增加亚组中,接受巩固免疫治疗的患者,其远处转移率显著低于未接受巩固免疫治疗的患者,并且远端无转移生存率(DMFS)显著更佳(图5D,E)。
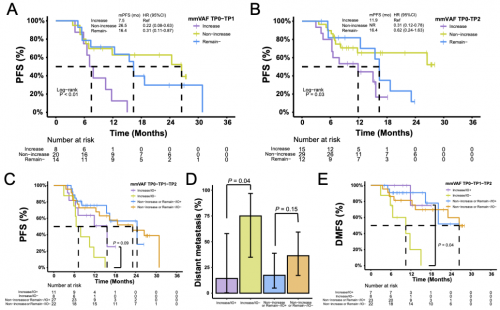
图5. ctDNA动态分析与克隆进化
结语
本研究创新性地发现,基于肿瘤组织和血浆ctDNA的mmVAF是评估肿瘤克隆性的分子指标,可以预测接受根治性放化疗的不可切除LA-NSCLC患者的预后。其次,巩固免疫治疗前ctDNA状态、mmVAF以及mmVAF的持续动态变化均可用于筛选可能从巩固免疫治疗中获益的患者。
本研究使用的瑞递康®放疗大Panel是世和基因联合国内多家顶尖放疗医学团队合作研发,适用于肿瘤患者的组织和血浆样本检测,包含放疗敏感性、耐受性和损伤易感相关基因,并涵盖现有靶向、化疗、免疫治疗相关基因,可用于提示放疗疗效及毒性反应,以及靶向、化疗、免疫治疗方案的指导,辅助临床治疗决策。
参考文献
[1] Yang Y, Wang J, Wang J, et al. Unrevealing the therapeutic benefits of radiotherapy and consolidation immunotherapy using ctDNA-defined tumor clonality in unresectable locally advanced non-small cell lung cancer. Cancer Lett. Published online December 13, 2023. doi:10.1016/j.canlet.2023.216569